Krebs: Tierversuche und tierversuchsfreie Forschung
In der westlichen Welt ist Krebs nach Herz-Kreislauf-Erkrankungen die zweithäufigste Todesursache. So starben im Jahr 2021 in Deutschland 229.068 Menschen an Krebs, das sind 22,4 % aller Verstorbenen (1). Trotz jahrzehntelanger Forschung an unzähligen sogenannten Tiermodellen und Unsummen investierter Zeit und Forschungsgelder, bleibt die Hoffnung auf Heilung von Krebs für viele Betroffene und ihre Angehörigen noch immer unerfüllt. Gleichzeitig kommen beständig neue Medikamente auf den Markt, die Pharmakonzernen zwar hohe Gewinne bescheren, aber für die Betroffenen oft nur einen geringen Nutzen haben. Dieser Beitrag beleuchtet die Gründe für das Versagen der vorwiegend tierexperimentell ausgerichteten Krebsforschung und zeigt humanrelevante tierversuchsfreie Forschungsmethoden auf.
Die Erkrankung
Unter der Bezeichnung Krebs werden bösartige Veränderungen verschiedener Organe und Blutzellen zusammengefasst. Dabei geraten Zellen außer Kontrolle, vermehren sich ungebremst, werden aggressiv und können in umgebendes Gewebe eindringen und dieses zerstören.
In Deutschland wurden im Jahr 2019 laut Schätzungen des Zentrums für Krebsregisterdaten 502.655 Krebserkrankungen erstmalig diagnostiziert. In etwa der Hälfte der Fälle waren Brustdrüse, Prostata, Dickdarm oder Lunge betroffen (2). Doch selbst wenn ein und dasselbe Organ von Krebs befallen ist, unterscheiden sich die Tumorzellen von Patient zu Patient und selbst innerhalb eines Tumors differieren die Zellen erheblich (3). Zudem verändert sich der Tumor auch im Laufe der Zeit und eine Therapie, die zunächst gut anschlägt, indem sie einen Teil der Krebszellen abtötet, kann im späteren Verlauf der Behandlung wirkungslos werden.
Die Behandlungsmöglichkeiten
So vielfältig Krebserkrankungen und individuelle Verläufe der Erkrankung sind, so unterschiedlich sind auch die Behandlungsmöglichkeiten: Tumoren können in einer Operation entfernt werden oder mit einer Bestrahlung so geschädigt werden, dass sie im Idealfall absterben. Klassische Chemotherapien bremsen die Teilung und Vermehrung von Krebszellen ab. Antihormontherapien sollen bestimmten Tumoren die Wachstumsgrundlage entziehen. Neuere Krebstherapien basieren auf Antikörpern oder Immunzellen, die Krebszellen gezielt angreifen und abtöten sollen. Trotz dieser vielfältigen Behandlungsstrategien, die häufig miteinander kombiniert werden, ist die Überlebensaussicht bei vielen Krebserkrankungen noch immer gering und liegen bei bösartigen Tumoren der Lunge, Leber und Bauchspeicheldrüse bei unter 20 % (2). So werden immer weitere Medikamente gegen Krebs entwickelt.
Neue Medikamente
Zwischen 2009 und 2013 wurden durch die Europäische Arzneimittel-Agentur (EMA) 48 Krebsmedikamente für 68 verschiedene Indikationen zugelassen. Für lediglich 24 Indikationen (35 %) war zum Zeitpunkt der Zulassung ein Gewinn an Überlebenszeit in Studien an Patienten nachgewiesen worden. Dieser Gewinn an Zeit betrug im Schnitt 2,7 Monate (1,0 – 5,8 Monate). Ein Gewinn an Lebensqualität wurde lediglich für 7 von 68 Indikationen (10 %) nachgewiesen.
In der Phase nach dem Markteintritt wurden die Medikamente weiter bewertet und auch nach durchschnittlich 5,4 Jahren Beobachtung wurde für lediglich 51 % der Indikationen eine Verlängerung der Überlebenszeit oder Erhöhung der Lebensqualität gefunden. Dabei fiel der Gewinn an Lebenszeit für die Hälfte der Indikationen so gering aus, dass er klinisch keinerlei Bedeutung hatte (4).
Viele der neuen Medikamente weisen also einen eher bescheidenen Nutzen auf. Dies liegt daran, dass zur Bewertung neuer Medikamente häufig Kriterien wie die Tumorgröße oder eine kurzfristige „Stabilität“ der Krankheit herangezogen werden. Ob diese jedoch für den Patienten zu einem spürbaren Nutzen führen, ist fraglich. Und selbst wenn der neue Wirkstoff nützt, wird der Gewinn von wenigen Monaten Lebenszeit häufig um den Preis von zum Teil schwerwiegenden Nebenwirkungen teuer erkauft.
Hohe Fehlerraten bei der Medikamentenentwicklung
Bei der Entwicklung neuer Krebsmedikamente ist die Abbruchrate, also der Anteil von Wirkstoffen, der es aus der Entwicklungsphase nicht bis zum Markteintritt schafft, besonders hoch. Nur ca. 5 % der Wirkstoffe, für die bei der US Food and Drug Administration (FDA) ein Antrag auf Zulassung eines neuen Prüfarzneimittels (IND) gestellt wurde, welcher für die Testung neuer Wirkstoffe am Menschen nötig ist, erreichen tatsächlich den Markt (5). Die Hauptgründe dafür, dass so viele Wirkstoffe scheitern, sind mangelnde Wirksamkeit und Sicherheit.
Woran liegt es, dass so viele Wirkstoffe, deren Wirksamkeit und Sicherheit in der präklinischen Phase erfolgreich gezeigt wurden, in den klinischen Phasen, also der Untersuchung an Menschen, versagen? Der Verdacht liegt nahe, dass die in der präklinischen Forschung verwendeten Methoden keine aussagekräftigen Vorhersagen über die Wirkung auf den Menschen ermöglichen.
Die Modelle
In der Krebsforschung werden neben In-vitro-Methoden, also beispielsweise Untersuchungen an Zellkulturen, vor allem sogenannte Tiermodelle verwendet, an denen versucht wird, die Ursachen und Behandlungsmöglichkeiten der menschlichen Erkrankung zu erforschen (6). Dabei werden die verschiedensten Tierarten zur „Herstellung“ solcher Modelle eingesetzt, meist kleine Tiere wie Mäuse, Ratten, Zebrafische und Fruchtfliegen (6).
Am häufigsten werden Mäuse eingesetzt, weil sie billig und unkompliziert zu halten sind und einfach gentechnisch verändert werden können (6). Auch Zebrafische werden zunehmend in der Krebsforschung eingesetzt, jedoch nicht, weil sie dem Menschen so ähnlich sind und so eine gute Vorhersage der Wirkung auf den menschlichen Organismus ermöglichen. Tatsächlich werden sie eingesetzt, weil sie klein und günstig sind und sich schnell vermehren lassen. Oft wird an den Zebrafischlarven geforscht, die transparent sind, wodurch sich beispielsweise die Bildung von Metastasen leicht beobachten lässt. Auch ist die gentechnische Veränderung von Zebrafischen vergleichsweise einfach, da die Eizellen außerhalb des Körpers befruchtet werden und nicht in Leihmütter übertragen werden müssen. So lassen sich sogenannte Zebrafischmodelle für verschiedene Erkrankungen relativ einfach etablieren (6).
Während wegen ihrer einfachen Vermehrung, geringen Kosten und leichten Haltung also vor allem kleinere Tierarten verwendet werden, sind manche Eingriffe wie Operationen und Bestrahlungen einfacher an größeren Tieren durchzuführen. Daher werden auch Schweine und Hunde in der Krebsforschung eingesetzt.
Tiere in der deutschen Krebsforschung
Der „Verbrauch“ von Tieren in der Krebsforschung ist enorm. So wurden in Deutschland im Jahr 2021 in den Bereichen Grundlagenforschung sowie Translationale und Angewandte Forschung 210.273 Tiere verwendet. Wie viele Tiere zusätzlich für die Zucht und den Erhalt von gentechnisch veränderten Tieren - was gerade in der Krebsforschung häufig vorkommt - verwendet wurden, ist ebenso wie die Anzahl der Tiere in der Qualitätskontrolle von Krebsmedikamenten, nicht bekannt. Zusammen mit den Tieren, die für die Krebsforschung gezüchtet wurden, aber aus verschiedenen Gründen wie dem falschen Alter oder der falschen genetischen Ausstattung als sogenannte „Überschusstiere“ getötet werden (7), dürfte die Anzahl der Tiere, die tatsächlich in Deutschland für die Krebsforschung leiden und sterben, um ein Vielfaches höher liegen.
|
Grundlagen-Krebsforschung |
Angewandte Krebsforschung |
Zucht gentechnisch veränderter Tiere |
Qualitäts-kontrolle |
Überschusstiere |
|
|
Mäuse |
1023.46 |
104.900 |
? |
? |
? |
|
Ratten |
454 |
727 |
? |
? |
? |
|
Meerschweinchen |
10 |
- |
- |
? |
? |
|
andere Nagetiere |
65 |
- |
- |
- |
? |
|
Katzen |
4 |
- |
- |
- |
? |
|
Hunde |
- |
21 |
- |
- |
? |
|
Schweine |
45 |
120 |
- |
- |
? |
|
Krallenfrösche |
30 |
- |
- |
- |
? |
|
Zebrafische |
1364 |
- |
? |
- |
? |
|
Andere Fische |
163 |
- |
- |
- |
? |
|
Kaninchen |
10 |
9 |
? |
? |
? |
|
Rhesusaffen |
- |
1 |
- |
- |
? |
|
Krallenaffen |
- |
4 |
- |
- |
? |
|
Summe |
104.491 |
105.782 |
? |
? |
? |
Tabelle 1: Anzahl der in Deutschland im Jahr 2021 für die Krebsforschung verwendeten Tiere.
Wie Tiere zum „Modell“ werden
Viele Krebserkrankungen kommen bei Tieren natürlicherweise kaum vor. Daher müssen sie bei den Tieren künstlich hervorgerufen werden, um auf diese Weise sogenannte Tiermodelle für die Krebsforschung „herzustellen“. Hierfür kommen verschiedene Methoden zur Anwendung:
- Chemische Induktion:
Dabei wird den Tieren eine krebserzeugende Substanz verabreicht. Weil es jedoch lange dauert, bis sich in der Folge ein Tumor bildet, werden zumeist andere „Tiermodelle“ bevorzugt, die schneller „einsatzbereit“ sind. - Genetische Programmierung:
Bei der genetischen Programmierung werden entweder bestimmte krebsfördernde Gene gentechnisch aktiviert oder aber andere Gene, welche normalerweise die Bildung von Krebs verhindern, indem sie beispielsweise veränderte Zellen zum Absterben bringen, werden gentechnisch ausgeschaltet (6). - Transplantation von Krebszellen:
Je nach Modell werden Krebszellen tierischen oder menschlichen Ursprungs dem Tier injiziert und diese wachsen an der Injektionsstelle zu einem Tumor heran. Dies erfolgt häufig unter der Haut der Tiere, da sich dort das Tumorwachstum einfach beobachten und messen lässt. In anderen Modellen werden die Tumorzellen auch direkt in das Organ gespritzt, in dem sich der ursprüngliche Tumor gebildet hat. Häufig werden für diese Modelle Tiere mit einem eingeschränkten Immunsystem („immundefizient“), das sich nicht gegen die fremden Zellen zur Wehr setzen kann, eingesetzt. Dadurch wachsen die Tumore in rasanter Geschwindigkeit.
Aufgrund der häufigen Anwendung von durch Zellinjektion hergestellten „Tumormodellen“ werden diese in den folgenden Abschnitten näher beschrieben.
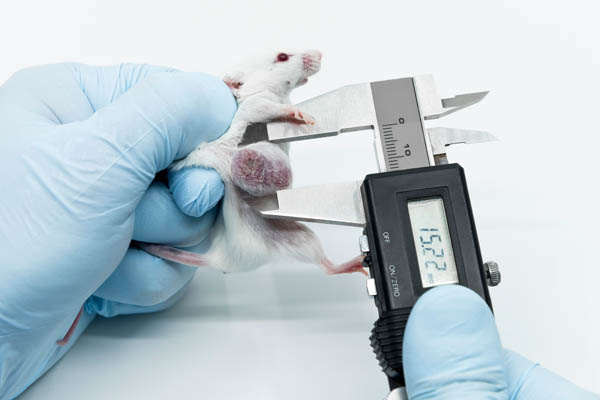
Xenograft-Modelle: Mäusen werden menschliche Tumorzellen unter die Haut gespritzt, weil sich der Tumor dann einfach vermessen lässt.
CDX-Modell
Häufig werden aus Tumorgewebe gewonnene Zelllinien zur Induktion von Tumoren eingesetzt. Das entsprechende „Modell“ wird Zelllinien-abgeleitetes Xenotransplantat (englisch: cell line-derived xenograft; CDX) genannt. Allerdings befinden sich die verwendeten Zelllinien bereits seit unzähligen Generationen in Kultur und haben sich dadurch an die Bedingungen, unter denen sie im Labor vermehrt werden, angepasst. Dadurch hat sich das biologische Verhalten der Zellen im Vergleich zu den Zellen des Tumors, aus dem sie ursprünglich gewonnen wurden, verändert. Zudem kann eine Zelllinie die Komplexität eines Tumors, der aus verschiedenen Zellen besteht und sich zudem noch im Verlaufe der Zeit verändert, nicht widerspiegeln.
PDX-Modell
Beim sogenannten PDX-Modell (englisch: patient-derived xenograft, deutsch: vom Patienten abgeleitetes Xenotransplantat) werden aus Biopsien oder bei der chirurgischen Entfernung eines Tumors gewonnene Proben eingesetzt. Dem Tier werden entweder von einem Patienten stammende Krebszellen oder aus diesen Zellen gewonnene Organoide injiziert oder kleine Stücken des Tumors implantiert. In dem Tier wächst dann ein menschlicher Tumor heran, der zumindest zu Beginn dem Tumor eines bestimmten Patienten entspricht. Diese Methode soll die Möglichkeit eröffnen, für individuelle Patienten maßgeschneiderte - sogenannte personalisierte - Therapien zu entwickeln und hat große Hoffnungen geweckt. Allerdings sind nicht alle Tumortypen zur Erstellung von PDX-Modellen geeignet. Zudem dauert die Etablierung eines PDX-Modells oft Monate – Zeit, die viele Patienten nicht haben.
Limitierungen von CDX- und PDX-Modell
Auch wenn beim PDX-Modell der in den Tieren wachsende Tumor menschlichen Ursprungs ist, geschieht dies in Mäusen, deren Immunsystem sich ganz wesentlich von dem des Menschen unterscheidet. Häufig sind die Mäuse zudem gentechnisch so verändert, dass sie nicht über ein normal arbeitendes Immunsystem verfügen. Durch diese Abweichungen zwischen dem „Modell“ und dem menschlichen Patienten können die Wechselwirkungen zwischen dem Immunsystem und dem Tumor nicht nachgebildet oder vorhergesagt werden. Außerdem wächst der Tumor in einer Umgebung, die sich von der im menschlichen Patienten ganz erheblich unterscheidet. Die ihn umgebenen Zellen und Strukturen sind tierischen Ursprungs und die Signalmoleküle, mit der die Zellen miteinander kommunizieren, sind unterschiedlich (8). Daher lassen sich 60 – 70 % der mit Xeno-Modellen gewonnen Erkenntnisse zur Wirksamkeit von Substanzen nicht auf den Menschen übertragen (8), und die meisten in sogenannten Tiermodellen erfolgreich zur Behandlung von Krebs eingesetzten Wirkstoffe, zeigen bei menschlichen Patienten nicht den gewünschten Erfolg (6). Dies haben auch die Forschenden erkannt. Statt jedoch die verwendeten Methoden, bei denen tierische Organismen als Inkubator zur Anzucht von menschlichen Tumoren verwendet werden, generell in Frage zu stellen, werden immer neue Tiermodelle entwickelt und verfeinert, um so doch noch den lang ersehnten Durchbruch in der Krebsforschung liefern zu können.
Auf dem Weg zum perfekten Modell?
Um das Problem zu umgehen, dass der Tumor sich im sogenannten Tiermodell mit einem nicht-menschlichen und künstlich geschwächten Immunsystem konfrontiert sieht, welches ganz anders reagiert als das Immunsystem des Menschen, wurden zahlreiche Versuche unternommen, um Teilaspekte eines menschlichen Immunsystems in sogenannten humanisierten Modellen nachzubilden.
Dafür werden beispielsweise menschliche hämatopoetische Stammzellen, das sind Stammzellen die sich beim Menschen überwiegend im Knochenmark befinden und aus denen verschiedene Blutzellen, so auch Immunzellen, hervorgehen, in Mäuse implantiert. Bei anderen humanisierten Modellen werden Zellen von menschlichen Embryonen in die Nierenkapsel von immundefizienten Mäusen implantiert, denen zusätzlich hämatopoetische Stammzellen aus demselben Embryo gespritzt werden (9). Da menschliche Stammzellen und menschliche Embryonen nur in geringem Umfang zur Verfügung stehen und gerade der Einsatz von Embryonen zudem reglementiert ist, werden häufig einfach aus Spenderblut gewonnene menschliche Lymphozyten in immundefiziente Mäuse injiziert. Das Problem dabei ist, dass es häufig zu der sogenannten Graft-versus-Host Erkrankung (GvHD) kommt, bei der sich die implantierten menschlichen Immunzellen gegen die Zellen der Maus richten. Dadurch wird die Lebenspanne der Tiere reduziert, was den Untersuchungszeitraum verkürzt (6).
Warum Tierexperimente versagen
Trotz jahrzehntelanger Forschung – nicht nur an Behandlungsmöglichkeiten für Krebs, sondern vor allem auch an der Entwicklung immer neuer sogenannter Tiermodelle und der „Verfeinerung“ bestehender Tiermodelle – bleibt die Bilanz der tierexperimentellen Krebsforschung weit hinter den von ihr gemachten Versprechungen zurück. Ursächlich dafür ist die schlechte Übertragbarkeit der von in Tierversuchen gewonnenen Erkenntnisse auf den Menschen, für welche es eine Reihe von Gründen gibt. Am offensichtlichsten sind die Unterschiede zwischen verschiedenen Spezies. So wurde festgestellt, dass nur 46 % der Chemikalien, die bei Ratten Krebs auslösen auch bei Mäusen karzinogen wirken (10). Da sich Maus und Ratte stammesgeschichtlich viel näherstehen als Maus und Mensch, ist es wenig verwunderlich, dass sich die Entstehung von menschlichen Krebserkrankungen nicht an Nagetieren nachvollziehen lässt.
Neben den offensichtlichen Unterschieden der verschiedenen Spezies krankt der ganze Forschungszweig auch an dem verzweifelten Versuch, mit offenbar ungeeigneten Modellen doch noch nützliche Erkenntnisse zu gewinnen. So werden die „Tiermodelle“ auf der Basis von jungen gesunden Tieren etabliert, die auch noch auf einem genetisch einheitlichen Inzuchtstamm basieren. Diese Tiere werden dann im Labor unter standardisierten Bedingungen gehalten und sehr oft handelt es sich um immundefiziente Tiere, d.h., ihnen wurde ein geschwächtes Immunsystem angezüchtet. Dies hat mit der Realität von Krebspatienten nichts gemein, die sich in ihrem Alter, ihrer genetischen Individualität, möglichen Begleiterkrankungen und in ihrem Lebensstil ganz wesentlich voneinander unterscheiden können.
So ist es nicht verwunderlich, dass nur etwa 5 % der Wirkstoffe, die die klinischen Phasen erreichen, auch eine Zulassung erhalten. Ungefähr 60 % der Wirkstoffe scheitern aufgrund mangelnder Wirksamkeit, obwohl sie in „Tiermodellen“ die gewünschte Wirkung erzielten (11). Dies belegt eindrucksvoll wie die Unterschiede zwischen Tier und Mensch zum Versagen der Krebsforschung führen.
Forschung direkt am Menschen?
Da die Unterschiede zwischen Mensch und Tier Hauptverursacher für die schlechten Erfolgsaussichten sind, liegt der Gedanke natürlich nahe, dass die direkte Forschung am Menschen zielführender sei. Und genau das wird Tierversuchsskeptikern häufig vorgeworfen. Allerdings sollte jedem bewusst sein, dass genau diese Versuche am Menschen unter der klangvolleren Bezeichnung „klinische Studie“ bereits zum Alltag gehören. Denn in diesen Studien werden Wirkstoffe - deren Wirksamkeit und Sicherheit in den präklinischen Studien unter Verwendung ungeeigneter Modelle bewertet wurden und die daher mit erheblichen Risiken verbunden sein können - erstmals am Menschen getestet. Natürlich sollen neue Wirkstoffe vor dem Einsatz in klinischen Studien möglichst gut untersucht und sicher sein. Der Sicherheit der Teilnehmer von klinischen Studien ist es jedoch keineswegs dienlich, wenn diese präklinischen Prüfungen an Tieren durchgeführt werden, deren Organismus ganz anders auf die Substanz reagiert. Moderne humanbasierte Modellsysteme haben bereits gezeigt, dass sie besser zur Bewertung der Sicherheit von Wirkstoffen geeignet sind als sogenannte Tiermodelle (12).
Tierversuchsfreie Forschungsmethoden
In der präklinischen Forschung, d.h. in der Entwicklung und Testung von potenziellen Krebstherapien, kommen außer Tierversuchen auch heute schon zellbasierte Verfahren zum Einsatz. Relativ häufig werden dazu einfache Zellmodelle verwendet, so zum Beispiel menschliche Krebszellen, die entweder auf Zellkulturoberflächen wachsen oder als kleine Mini-Tumore in Organoid-Form untersucht werden. Diese Modelle sind einfach und kostengünstig und ermöglichen beispielsweise die Untersuchung, ob ein potenzieller Wirkstoff zum Absterben der Krebszellen führt. Allerdings fehlt diesen Modellen die nötige Komplexität, da sie rein auf die Tumorzellen fokussiert sind und die natürliche Umgebung des Tumors, wie einsprießende Blutgefäße oder benachbarte Zellen unberücksichtigt lassen (13).
Um diese Limitierungen zu umgehen, wurden humanbasierte Modelle entwickelt, die auch die direkte Tumorumgebung und die systemische Wechselwirkung des zu untersuchenden Wirkstoffs mit verschiedenen Organen berücksichtigen können.
Organoide und PDO-Modell
Bei Organoiden handelt es sich um kleine runde Zellanordnungen. Wenn sie aus Tumorzellen gewonnen werden, können sie bestimmte Eigenschaften des Tumors besser nachbilden als einfache Monolagen von Zellen. So bildet sich zum Zentrum des Organoids ein Sauerstoff- und Nähstoffgradient aus, wie er auch in Tumorgewebe vorkommt. Werden die Tumor-Organoide nicht aus Zelllinien, sondern aus Biopsie-Material gewonnen, spricht man von sogenannten Parienten-eigenen Organoiden (englisch: patient-derived-organoids: PDO), in denen individuelle Merkmale des ursprünglichen Tumors konserviert werden (14).
Im Gegensatz zum PDX-Modell, lassen sich PDO-Modelle von beliebigen Tumortypen gewinnen, sind in wenigen Wochen etabliert und ermöglichen ein Hochdurchsatzscreening von Wirkstoffen. So werden PDO-Modelle bereits heute in der Suche nach neuen Wirkstoffen eingesetzt (14). Allerdings wird sich beim PDO-Modell ausschließlich auf den Tumor fokussiert, so dass die systemische Wirkung einer Substanz nicht erfasst werden kann.
Organ-auf-dem-Chip-Modelle in der Krebsforschung
Um auch die Wechselwirkungen zwischen Tumor und anderen Geweben sowie den Stoffwechsel berücksichtigen zu können, wurden Organ-auf-dem-Chip-Systeme entwickelt. Diese basieren auf einem sogenannten mikrofluidischen Chip, auf dem mehrere kleine Kultivierungskammern durch feine Kanäle miteinander verbunden sind. In jeder der Kammern können verschiedene Zellen oder Gewebe kultiviert werden und durch die Kanäle zirkulierende Nährflüssigkeit ahmt den Blutstrom nach und transportiert Nährstoffe, aber auch Wirkstoffe oder ihre Stoffwechselprodukte zu den Zellen. Auch weitere Aspekte der Tumorumgebung lassen sich imitieren, so zum Beispiel die extrazelluläre Matrix, also das Substanzgemisch, welches den Raum zwischen den Zellen ausfüllt, oder auch natürliche Barrieren, die durch mit Zellen bewachsene Membranen nachgebildet werden können.
Exemplarisch sei hier ein von Jose M. Ayuso et al. 2019 publizierter mikrofluidischer Chip skizziert: In diesem System werden Tumor-Organoide in einer dreidimensionalen Matrix, welche die Mikroumgebung des Tumors im lebenden Organismus simuliert, kultiviert. Angrenzend an diese Matrix befinden sich feine Kanäle, welche mit Endothelzellen bewachsen sind und die somit Blutgefäße simulieren. Wirkstoffe und Immunzellen, die die Tumor-Organoide bekämpfen sollen, können in diese nachgebildeten Blutgefäße eingebracht werden, so dass das System eine Simulation der Injektion von Wirkstoffen oder Immuntherapien in die Blutbahn ermöglicht. Auch die direkte Untersuchung der Interaktion zwischen Tumor- und Immunzellen ist damit durchführbar (15).
Das „Hintereinanderschalten“ verschiedener Kammern, in denen Zellen von unterschiedlichen Organen kultiviert werden ermöglicht darüber hinaus nicht nur die Ermittlung der Wirkung einer Substanz, sondern auch die Untersuchung der Pharmakokinetik, also der Verteilung des Wirkstoffs in verschiedenen Organen und seinen Um- und Abbau durch verschiedene Zelltypen.

Mikrofluidische Systeme ermöglichen die Untersuchung von Wirkstoffen in einem menschlichen Multi-Organsystem.
3D-gedruckte Tumormodelle
Tumore entstehen in einer komplexen Umgebung, die aus verschiedenen Zellen und der sogenannten extrazellulären Matrix aufgebaut ist. Diese Umgebung kann mittels 3D-Druck nachgeformt werden. Der 3D-Biodruck verwendet dabei biokompatible „Tinten“, beispielsweise aus Hydrogelen, in die Zellen eingeschlossen werden. So lassen sich verschiedene Zelltypen wie Bindegewebs-, Fett- und Immunzellen ebenso wie Gefäße, die den Tumor mit Nährstoffen versorgen, in einer definierten dreidimensionalen Anordnung drucken (16). Auch weitere wichtige bioaktive Komponenten können in das 3D-Konstrukt eingebracht werden. So können komplexe Gewebe wie Tumore mit ihrer unmittelbaren Umgebung, die Anteil hat am Wachstum des Tumors und der Bildung von Metastasen, aber auch daran ob und wie gut Wirkstoffe die Tumorzellen erreichen, in vitro nachgebildet werden.
Natürlich lassen sich die genannten In-vitro-Methoden auch miteinander kombinieren. So können Tumor-Organoide in 3D-gedruckten Konstrukten in einem mikrofluidischen System integriert werden (17,18). Dadurch lassen sich die Vorteile der einzelnen Systeme in Synergie nutzen und es können für beliebige wissenschaftliche Fragestellungen maßgeschneiderte Modelle zur Verfügung gestellt werden.
Den Ursachen auf den Grund gehen
Auf zellulärer Ebene kann Krebs entstehen, wenn mehrere Änderungen im Erbgut (Mutationen) vorliegen. Die meisten dieser Mutationen treten spontan auf oder werden durch äußere Faktoren begünstigt. Nur ca. 5-10 % der Krebserkrankungen werden durch bereits vorhandene genetische Defekte verursacht (19). Die anderen Fälle werden durch verschiedene Umwelt- und Lebensstil-Faktoren verursacht, von denen sich viele vermeiden oder zumindest minimieren lassen.
Darüber, wie viele der Krebsfälle sich vermeiden ließen, gibt es unterschiedliche Angaben. Die WHO geht davon aus, dass sich weltweit 30-50 % der Krebsfälle durch Vorbeugung verhindern ließen, das Deutsche Krebsforschungszentrum (DKFZ) schätzt, dass sich 37 % der Krebserkrankungen in Deutschland vermeiden ließen (2) und einige Experten gehen davon aus, dass allein 60-70 % der Krebsfälle durch Tabak und die Ernährung verursacht werden und somit vermeidbar wären (19).
Vorbeugen ist möglich
So lassen sich bis zu 30-35 % der Krebs-bedingten Todesfälle auf die Ernährung zurückführen, wobei der Anteil für bestimmte Krebserkrankungen wie Darmkrebs noch wesentlich höher sein kann (19). Ursächlich dafür ist neben der Aufnahme von Karzinogenen wie Nitraten, Nitrosaminen und Pestiziden vor allem auch der Verzehr von Fleisch, in welchem beim Kochen oder Braten krebserzeugende heterozyklische aromatische Amine entstehen (20). Dagegen wurde für pflanzliche Nahrungsmittel ein schützender Effekt gefunden (21).
25-30 % der Krebs-bedingten Todesfälle werden durch Tabakprodukte verursacht. Tabak enthält über 50 Karzinogene und der Genuss von Tabakprodukten wird für 87 % der Todesfälle durch Lungenkrebs verantwortlich gemacht. Daneben erhöht Tabakkonsum auch das Risiko für mindestens 13 weitere Krebserkrankungen.
Weitere 15-20 % der Krebs-bedingten Todesfälle werden durch Infektionen, zumeist durch Viren, verursacht. Zu den Viren, die Krebs auslösen können, gehören unter anderem Humane Papillomviren (HPV), das Eppstein-Barr-Virus, das Humane Immundefizienz-Virus (HIV) und das Hepatitis-B-Virus (HBV) (19). Für HPV steht seit einigen Jahren ein Impfstoff zur Verfügung, der die Bildung von Gebärmutterhalskrebs verhindern soll. Für viele Viren, inklusive HPV, lässt sich das Ansteckungsrisiko jedoch auch mit vergleichsweise einfachen Mitteln, wie dem Verzicht auf ungeschützten Geschlechtsverkehr, deutlich verringern.
Die verbleibenden Krebstodesfälle lassen sich auf andere Faktoren wie Strahlung, Stress und Umweltverschmutzungen zurückführen. Auch werden Krebserkrankungen durch Alkoholkonsum, Übergewicht und Bewegungsmangel begünstigt (22). Hier ergeben sich viele Präventionsmöglichkeiten, vom einfachen Auftragen von Sonnenschutzmitteln bis hin zu wesentlich schwerer zu realisierenden aber in vielfacher Weise lohnenden Maßnahmen wie dem Schutz unserer Umwelt.
Fazit: Mit Prävention und humanbasierter Forschung zum Sieg über den Krebs
Während jeder Einzelne durch eine gesunde Ernährung mit hohem pflanzlichen Anteil und dem Verzicht auf das Rauchen bereits ganz wesentlich zu seiner persönlichen Krebsprophylaxe beitragen kann, gibt es auch Faktoren, die sich schlechter oder gar nicht vermeiden lassen. Natürlich wird daher auch weiterhin Krebsforschung nötig sein. Damit Patienten davon aber optimal profitieren können, muss diese mit human-basierten Methoden erfolgen, um so einerseits möglichst wirksame und sichere Wirkstoffe zu finden, andererseits aber auch zu verhindern, dass hochwirksame Substanzen fälschlicherweise aussortiert werden, weil sie im falschen Organismus - beim Tier - versagen oder zu inakzeptablen Nebenwirkungen führen.
Was nützt es, in einem vollständigen Modell-Organismus zu forschen, wenn es sich dabei um den falschen Organismus handelt, der keine Vorhersagen über die Wirkung einer Substanz im menschlichen Körper ermöglicht? Und um wie viel weiter wären humane Krebsmodelle, wenn all der Forschergeist, all die Zeit und all die Fördermittel, die in die Entwicklung immer neuer Tiermodelle gesteckt werden, stattdessen in eine zukunftsweisende humanbasierte Forschung fließen würden?
09.03.2023
Dr. Johanna Walter
Quellen
- DESTATIS: Todesursachenstatistik 2021: 7 % aller Todesfälle gehen direkt auf COVID-19 zurück, Pressemitteilung Nr. 544 vom 16. Dezember 2022, https://www.destatis.de/DE/Presse/Pressemitteilungen/2022/12/PD22_544_23211.html (Zugriff am 23.02.2023)
- Zentrum für Krebsregisterdaten: Krebs gesamt, https://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Krebs_gesamt/krebs_gesamt_node.html (Zugriff am 23.02.2023)
- Sun X. et al. Intra-tumor heterogeneity of cancer cells and its implications for cancer treatment. Acta Pharmacologica Sinica 2015; 36(10):1219–1227
- Davis C. et al. Availability of evidence of benefits on overall survival and quality of life of cancer drugs approved by European Medicines Agency: retrospective cohort study of drug approvals 2009-13. BMJ 2017; doi: 10.1136/bmj.j4530:j4530
- Greek R: Animal Models of Cancer in Light of Evolutionary Biology and Complexity Science. Americans For Medical Advancement, 2014.
- Li Z. et al. Application of Animal Models in Cancer Research: Recent Progress and Future Prospects. Cancer Management and Research 2021; Volume 13:2455–2475
- Strittmatter S: 4 Millionen Tiere als „Überschuss“ in Tierversuchslaboren getötet. 2021
- Kumari R: Targeting the Tumor Microenvironment. GEN: Genetic Engineering & Biotechnology News 2014
- Lan P. et al. Reconstitution of a functional human immune system in immunodeficient mice through combined human fetal thymus/liver and CD34+ cell transplantation. Blood 2006; 108(2):487–492
- di Carlo F.J. et al. Summary of Carcinogenicity Data Generated by the National Cancer Institute/National Toxicology Program. Drug Metabolism Reviews 1984; 15(5–6):1251–1273
- Hwang, T.J. et al. Failure of Investigational Drugs in Late-Stage Clinical Development and Publication of Trial Results. AMA Internal Medicine 2016; 176(12): 1826-1833
- Marshall L.J. et al. Poor Translatability of Biomedical Research Using Animals — A Narrative Review. Alternatives to Laboratory Animals 2023; doi: 10.1177/02611929231157756:026119292311577
- Alves A.H. et al. The Advances in Glioblastoma On-a-Chip for Therapy Approaches. Cancers 2022; 14(4):869
- Hou X. et al. Opportunities and challenges of patient-derived models in cancer research: patient-derived xenografts, patient-derived organoid and patient-derived cells. World Journal of Surgical Oncology 2022; 20(1):37
- Ayuso J.M. et al. Evaluating natural killer cell cytotoxicity against solid tumors using a microfluidic model. OncoImmunology 2019; 8(3):1553477
- Germain N. et al. Current Advances in 3D Bioprinting for Cancer Modeling and Personalized Medicine. International Journal of Molecular Sciences 2022; 23(7):3432
- Ma J. et al. Bioprinting of 3D tissues/organs combined with microfluidics. RSC Advances 2018; 8(39):21712–21727
- Wang X. et al. 3D bioprinted glioma microenvironment for glioma vascularization. Journal of Biomedical Materials Research Part A 2021; 109(6):915–925
- Anand P. et al. Cancer is a Preventable Disease that Requires Major Lifestyle Changes. Pharmaceutical Research 2008; 25(9):2097–2116
- Rohrmann S. et al. Heterocyclic aromatic amine intake increases colorectal adenoma risk: findings from a prospective European cohort study. The American Journal of Clinical Nutrition 2009; 89(5):1418–1424
- Vainio H. et al. Fruit and Vegetables in Cancer Prevention. Nutrition and Cancer 2006; 54(1):111–142
- Bericht zum Krebsgeschehen in Deutschland 2016. Zentrum für Krebsregisterdaten im Robert Koch-Institut (Hrsg). Berlin, 2016
