Impfstoffe: Tierversuche für Herstellung und Testung - und tierversuchsfreie Testmethoden
Impfstoffe sind immunologische Arzneimittel, die Teile (Antigene) von bakteriellen oder viralen Krankheitserregern beinhalten oder ihren Aufbau im Körper steuern und somit eine Immunantwort hervorrufen, die zu einer schützenden Immunität vor dem entsprechenden Erreger führt. Heutzutage sind mehr als 80% der Weltbevölkerung gegen einige schwere oder tödliche Krankheiten wie z.B. Diphtherie, Tetanus, Keuchhusten und Poliomyelitis prophylaktisch geimpft (1). Allerdings geht die Produktion der meisten Impfstoffe aus verschiedenen, größtenteils regulatorischen Gründen mit einem enormen Tierverbrauch und vielen Tierversuchen einher.
Im folgenden Text werden die wichtigsten Aspekte der Tierversuche und des Tierverbrauchs für die Herstellung und Testung von Impfstoffen für den Menschen beschrieben. Wir beleuchten 20 der am häufigsten verwendeten Human-Impfstoffe im Detail und erklären, ob und welche Tierversuche für ihre regelmäßigen Chargenprüfungen durchgeführt und ob tierische Komponenten beim Herstellungsprozess verwendet werden. Ähnliche Verfahren kommen auch bei Impfstoffen für Tiere zum Einsatz – sie sind aber nicht Gegenstand dieser Untersuchung. Ebenso wenig gehen wir hier auf Wirksamkeit und Impfschäden ein.
Ärzte gegen Tierversuche gibt keine Empfehlung, sich gegen eine Krankheit bzw. mit einem Impfstoff impfen zu lassen oder nicht. Das Ziel dieses Textes ist es, über die Lage der Impfstoffherstellung und -testung und den damit verbundenen Tierverbrauch zu informieren. Unser Verein ist nicht gegen Impfstoffe und Medikamente, sondern nur gegen die Art wie sie üblicherweise getestet werden, nämlich an Tieren. Wir sind der Überzeugung, dass es ohne Tierversuche nicht nur auch, sondern sogar viel besser, schneller und effizienter ginge, da humanbasierte Testmethoden im Gegensatz zum Tierversuch für den Menschen relevante Informationen liefern.
Die verschiedenen Impfstoff-Typen
Grundsätzlich unterscheidet man zwischen Lebend- und Totimpfstoffen. In den letzten Jahren werden auch einige genbasierte Impfstoffe verstärkt entwickelt und auf den Markt gebracht. Diese können als einzelne Gruppe beschrieben werden (2).
Lebendimpfstoffe bestehen aus chemisch oder physikalisch abgeschwächten Erregern (Viren oder Bakterien), die sich im menschlichen Körper eine Zeit lang vermehren, aber bei gesunden Personen keine Krankheit auslösen können. Einige Lebendimpfstoffe sind z.B. der Masern-Mumps-Röteln-Kombinations-Impfstoff und die Gürtelrose- und Windpocken-Impfstoffe.
Totimpfstoffe basieren auf abgetöteten Viren oder Bakterien. Dabei kann es sich sowohl um ganze Erreger (sog. Ganzkeimimpfstoffe wie Hepatitis-A- und FSME-Impfstoffe), als auch um einzelne Teile der Erreger, die als Antigene dienen (sog. Spalt- und Komponenten-Impfstoffe wie manche Influenza- und die Pneumokokken-Impfstoffe) handeln. Weiterhin bestehen manche Totimpfstoffe aus inaktivierten Bakterientoxinen (sog. „Toxoiden“, z.B. die Diphtherie- und Tetanus-Impfstoffe).
Bei den genbasierten Impfstoffen (mRNA-, DNA- und Vektorimpfstoffe) wird die genetische Information des Erregers für den Aufbau der gewünschten Antigene in den Körper eingebracht und die Antigene werden von den eigenen Zellen des Geimpften produziert. Die genetische Information kann in Form von DNA (zurzeit keine zugelassenen Impfstoffe für Menschen), mRNA (Corona-Impfstoffe der Firmen BioNTech/Pfizer und Moderna) oder harmlose Trägerviren mit der DNA für das Antigen (sog. Vektorimpfstoffe, z.B. die Ebola-Impfstoffe der Firma Janssen und die Corona-Impfstoffe der Firmen AstraZeneca und Janssen) übertragen werden.
Wie werden Impfstoffe reguliert?
Die Entwicklung, Herstellung und Prüfung von Impfstoffen unterliegt strengen Kontrollen sowohl beim Hersteller als auch bei Kontrollinstitutionen. Weltweit gelten die Anforderungen der Weltgesundheitsorganisation (WHO), die sowohl allgemeine Aspekte ganzer Impfstoffgruppen als auch spezifischer Produkte und Impfstoffkomponenten regeln (3). In der EU muss die Herstellung und Prüfung von jedem Impfstofftyp für jede Erkrankung (z.B. Influenza-Lebend- und Totimpfstoffe) die entsprechenden Vorschriften des Europäischen Arzneibuchs erfüllen. Zusätzliche Voraussetzungen und Richtlinien können auch auf nationaler Ebene greifen; in Deutschland sind diese die Vorgaben des Deutschen Arzneibuchs, des Arzneimittelgesetzes und der Arzneimittelprüfrichtlinien. In Deutschland ist das Paul-Ehrlich-Institut (PEI) für Impfstoffe verantwortlich und überwacht ihre Qualität, Wirksamkeit und Sicherheit (4).
Sowohl die internationalen WHO-Anforderungen, als auch die europäischen und deutschen Vorschriften verlangen mehrere Tierversuche u. a. für die Sicherheits- und Wirksamkeitsprüfungen der fertigen Impfstoffe und einiger ihrer Komponenten.
Tierversuche in der Impfstoffentwicklung
Weltweit werden geschätzt 10 Millionen Tiere jährlich für die Entwicklung und Prüfung von Impfstoffen und anderen immunologischen Arzneimitteln verbraucht.
Während der Impfstoffentwicklung wird üblicherweise eine große Palette von Tierversuchen zu zahlreichen Zwecken verwendet, bevor die Impfstoffe in den sogenannten klinischen Studien an Menschen getestet werden dürfen. Die klinischen Studien bestehen aus drei aufeinander folgenden Test-Phasen mit gesunden Probanden und Patienten, an denen Medikamenten- oder Impfstoffkandidaten getestet werden, um ihre Sicherheit und Wirksamkeit zu ermitteln. Ob ein Medikament oder ein Impfstoff für den Markt zugelassen wird, wird anhand dieser Ergebnisse entschieden. In Phase 4 werden Wirksamkeit und mögliche Nebenwirkungen nach der Vermarktung der Präparate überwacht. Bei den Tierversuchen, die vor der klinischen Prüfungen („Präklinische Phase“) gemacht werden, wird häufig bei verschiedenen Tierarten untersucht, ob z.B. der Impfstoffkandidat zu einer gewünschten Immunantwort bei den Tieren führt, ob er sie vor einer Infektion mit dem entsprechenden Krankheitserreger schützt, ob die Tiere Krankheitssymptome entwickeln und ihre Artgenossen anstecken können, ob und welche Nebenwirkungen nach einmaliger und mehrfacher Impfstoffgabe auftreten, wie sich der Impfstoff in den verschiedenen Organen verteilt, ob der Impfstoff für die Umwelt schädlich ist und andere.
Welche Tierversuche genau gemacht werden, entscheiden die Impfstoffhersteller anhand der internationalen und europäischen Vorschriften und nach Absprache mit den zuständigen Zulassungsbehörden. Dabei können verschiedene Hersteller mehrere und unterschiedliche Tierversuche für die Prüfung ähnlicher Aspekte und ähnlicher Impfstoffe durchführen. Die neuartigen Corona-Impfstoffe der Firmen BioNTech/Pfizer und Moderna basieren auf dem gleichen Prinzip (mRNA-Impfstoffe) und wirken gegen den gleichen Erreger (SARS-CoV-2), beide Impfstoffe wurden nach den WHO-Vorgaben an Mäusen, Ratten und Affen getestet, der Impfstoff von Moderna wurde aber zusätzlich an Hamstern getestet (5,6). In ähnlicher Weise wurden die beiden SarsCoV2-Vektorimpfstoffe der Firmen AstraZeneca und Janssen an Mäusen und Affen getestet; der Impfstoff von AstraZeneca wurde zusätzlich an Schweinen und Frettchen getestet und der von Janssen an Hamstern und Kaninchen (7,8).
Tierverbrauch für die Impfstoffherstellung

450-500 Millionen bebrütete Eier werden jährlich weltweit für die Herstellung von Impfstoffen verwendet. Bildquelle: flick.com/Governo do Estado de Sao Paulo (cc-by-2.0)
Nicht nur die Entwicklung, sondern auch die Herstellung der meisten Impfstoffe geht mit einem enormen Tierverbrauch einher. Tabelle 1 fasst die in der EU zugelassenen Produktionssysteme für 20 häufig verwendete Impfstoffe für Menschen zusammen. Viele Impfstoffe werden in bebrüteten Hühnereiern produziert, weil manche Viren, wie das Influenza-Virus, die für die Herstellung von Impfstoffen verwendet werden, sich im Ei oder im Hühner-Embryo vermehren können. Diese beinhalten halb entwickelte, schmerzempfindliche Embryonen, die während der Impfstoffsaufbereitung getötet werden. Nach einer Schätzung der WHO werden 450-500 Millionen Eier weltweit jährlich für die Herstellung von Impfstoffen verwendet, ein großer Teil davon geht in die Produktion von Influenza-Impfstoffen (9). Neben den ethischen Problemen gibt es bei diesen Produktionsmethoden auch gesundheitliche Bedenken, da die Viren, die als Lebendimpfstoff benutzt werden, schnell innerhalb der Eier mutieren, was die Wirksamkeit des Impfstoffs stark reduzieren kann (9,10). Solche Virusmutationen des Influenza-Virus sind vermutlich der Grund, warum der Grippe-Impfstoff 2018 eine Wirksamkeit von nur 36% hatte (9).
Andere Impfstoffe werden in tierischen Zellen vermehrt: Dabei handelt es sich entweder um Zellen, die direkt vom Tier entnommen werden („primäre Zellen“) oder um „permanente Zelllinien“, die über mehrere Jahre und Jahrzehnten hinweg nach der einmaligen Gewinnung vom Tier vermehrt und verwendet werden. Manche Impfstoffe, wie der Röteln-Impfstoff, werden in menschlichen Zellen produziert. Weiterhin werden die Impfstoffe gegen bakteriellen Erreger wie die Diphtherie-, Tetanus- oder Meningokokken-Impfstoffe in Bakterienkulturen hergestellt. Einige Impfstoffe, wie die gegen Hepatitis B oder einige gegen das humane Papillomavirus, werden in Hefe produziert. Die mRNA-Impfstoffe gegen das Coronavirus werden völlig in vitro, d.h. im Reagenzglas, produziert, nur für einige Zwischenschritte werden Bakterienkulturen verwendet.
Eine relativ neue, aber vielversprechende und tierleidfreie Methode zur Impfstoffproduktion stellt die Tabakpflanze dar. Impfstoffe können in den schnellwachsenden Pflanzen in großen Mengen gezüchtet und aufbereitet werden. Da die Tabakpflanzen eine völlig andere Umgebung für die menschlichen Viren darstellen, finden keine unerwünschten Reaktionen zwischen Pflanzen und Viren und keine Veränderungen der Impfstoffstruktur statt. Der Tabakhersteller Britisch American Tobacco entwickelt mittels dieser Technologie einen Influenza- und einen Corona-Impfstoff. Beide Impfstoffe werden bereits in klinischen Studien an Menschen getestet und sind möglicherweise bei Raumtemperatur stabil, was erhebliche Vorteile bieten würde (11).
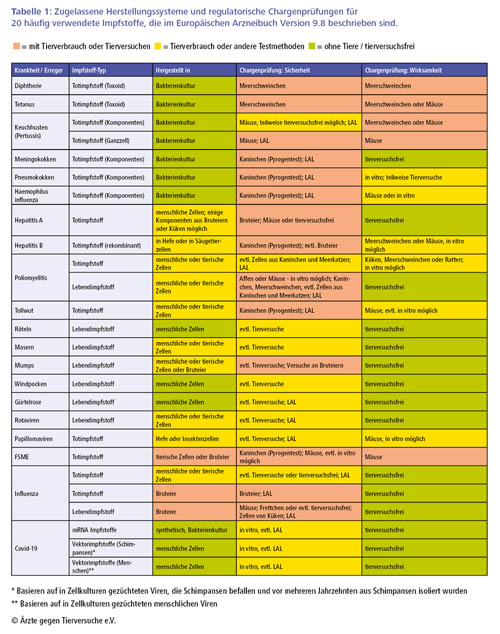
Tabelle 1: Zugelassene Herstellungssysteme und regulatorische Chargenprüfungen für 20 häufig verwendete Impfstoffe, die im Europäischen Arzneibuch Version 9.8 beschrieben sind.
Tabelle als PDF >>
Gibt es vegane Impfstoffe?
Im Laufe der Routine-Impfstoffherstellung werden häufig tierische Materialien wie das berüchtigte fetale Kälberserum (FKS), Kuhmilch, Gelatine, Enzyme, Fleischextrakte, Eier und Federn benutzt. Viele von diesen Materialien werden als Hilfs- oder Trägerstoffe verwendet, einige werden in den Geräten und Verpackungsmaterialien eingesetzt. Häufig werden diese Komponenten vor den letzten Schritten der Impfstoffherstellung entfernt, damit der fertige Impfstoff keine oder nur wenige Inhaltsstoffe tierischen Ursprungs beinhaltet, weil diese ein potenzielles Gesundheitsrisiko für die Menschen darstellen können. Wer sich aber aus ethischen Gründen für einen veganen Impfstoff bzw. Impfstoff mit minimalem Tierverbrauch interessiert, will sicherlich auch wissen, ob tierische Materialien für den Herstellungsprozess verwendet wurden, auch wenn diese nicht im fertigen Impfstoff vorhanden sind.
Fetales Kälberserum (FKS): wissenschaftlich und ethisch verwerflich
Fetales Kälberserum (FKS), das aus dem Blut ungeborener Kälber auf grausame Weise gewonnen wird, wird häufig als „Goldstandard“ bei der Zusammensetzung der Nährmedien für die Züchtung etlicher Zellen verwendet. FKS stellt sowohl ethische, als auch wissenschaftliche Probleme dar, weil seine Gewinnung mit großem Tierleid einhergeht und weil es Reaktionen in den menschenbasierten Modellen verursachen kann, die es natürlicherweise im menschlichen Körper nicht gibt. Es gibt mittlerweile verschiedene Nährmedien, die statt FKS humanes Blutplättchen-Lysat (hPL) enthalten, das aus abgelaufenen Blutspenden hergestellt wird und viele ethische und wissenschaftliche Vorteile hat.
Um einen Überblick zu schaffen, welche der 20 am häufigsten verwendeten Impfstoffe mithilfe tierischer Materialien produziert werden, haben wir die offiziellen Informationen der Europäischen Arzneimittel-Agentur (EMA) ausgewertet (Tabelle 2). Seit 1995 verfasst die EMA European Public Assessment Reports (EPAR), Berichte über alle Medikamente, die in der EU zugelassen werden (12). Die EPAR-Berichte beschreiben u.a. die Produktionssysteme sowie ob und welche tierischen Komponenten für die Herstellung verwendet werden. In Tabelle 2 ist rot gekennzeichnet, wenn tierische Materialien wie Bruteier oder primäre tierische Zellen verwendet werden. Mit Gelb sind Impfstoffe markiert, für die nicht klar beschrieben ist, ob und welche tierischen Stoffe für ihre Herstellung benutzt werden oder solche, die in permanenten tierischen Zelllinien vermehrt werden, die ursprünglich von Tieren stammen aber keinen dauerhaften Tierverbrauch verursachen. Mit Grün sind Impfstoffe markiert, die völlig tierfrei produziert werden. Es gibt mehrere Impfstoffe, zu denen keine EPAR-Berichte verfügbar sind, vermutlich, weil sie vor 1995 zugelassen wurden, beispielsweise alle Tollwut- und FSME-Impfstoffe (Frühsommer-Meningoenzephalitis).
Leider werden für die meisten Impfstoffe, auch für diejenigen, die ohne tierische Materialien hergestellt werden, routinemäßig eine ganze Palette an qualvollen Tierversuchen durchgeführt.

Tabelle 2: Informationen der Europäischen Arzneimittel-Agentur (EMA) zur Verwendung von tierischen Zellen, Bruteiern oder anderen tierischen Materialien für häufig verwendete Impfstoffe.
Tabelle als PDF >>
Tierversuche für die Impfstoff-Chargenprüfungen
Aufgrund ihrer biologischen Natur können die Qualität und Wirksamkeit von Impfstoffen während der Herstellung variieren. Deswegen unterliegen Impfstoffe, im Gegensatz zu den meisten anderen Medikamenten, nicht nur einer einmaligen Kontrolle während des Zulassungsverfahrens, sondern jede Produktionseinheit (Charge) wird in den sogenannten Chargenprüfungen geprüft, bevor sie in den Handel abgegeben werden darf (13). So werden Sicherheit und Wirksamkeit von jeder Impfstoff-Charge getestet, was häufig mit zahlreichen, sehr qualvollen Tierversuchen verbunden ist. Nach einer Schätzung werden weltweit 10 Millionen Tiere jährlich für die Entwicklung und Prüfung von Impfstoffen und anderen immunologischen Arzneimitteln verbraucht, ca. 80% davon in den Routine-Chargenprüfungen (14). Ein Grund für die hohen Tierzahlen ist, dass i.d.R. nicht nur die fertigen Impfstoffe, sondern auch die aktive Substanz und einige Hilfsstoffe (z.B. Adjuvanzien) routinemäßig getestet werden. Auch die biologischen Komponenten des Produktionssystems wie Zellen oder Bruteier unterliegen regelmäßigen Chargenprüfungen. Weiterhin werden häufig mehrere Verdünnungen sowohl des fertigen Impfstoffs, als auch seiner Bestandteile in Tierversuchen überprüft, was zu einer weiteren Steigerung der Tierzahlen führt. Darüber hinaus werden zusätzlich zu den Tierversuchen, die die Impfstoffhersteller im Rahmen der Chargenprüfungen durchführen, einige Tierversuche von den zuständigen staatlichen Arzneimittelkontrolllabors (OMCLs) wiederholt, d.h. in diesen Fällen wird die doppelte Anzahl von Tieren verwendet (15).
In Tabelle 1 (s.o.) sind die vom Europäischen Arzneibuch verlangten Tierversuche für jeden der 20 häufigsten Impfstoffe zusammengefasst (16).
Die Wirksamkeits-Chargenprüfung der meisten Lebendimpfstoffe, wie der Masern-Mumps-Röteln-Windpocken-Impfstoff und der Gürtelrose-Impfstoff, basiert nicht auf Tierversuchen, sondern umfasst verschiedene In-vitro-Testmethoden. Auch bei einigen Totimpfstoffen wie dem Meningokokken- und dem Influenza-Impfstoff, sowie bei genbasierten Impfstoffen (z.B. die Corona-Impfstoffe) wird die Wirksamkeit ohne den Einsatz von Tieren getestet. Im Gegensatz dazu werden umfangreiche Tierversuche für Routine-Wirksamkeitsprüfung der meisten Totimpfstoffe durchgeführt. So müssen für die Wirksamkeitsprüfung einer jeden Charge der Diphtherie-, Tetanus-, Keuchhusten- und Tollwut-Impfstoffe mehr als 100 Tiere leiden und sterben (14). Am häufigsten werden Mäuse und Meerschweinchen verwendet, manchmal auch Küken und Ratten wie etwa für den Poliomyelitis-Totimpfstoff.
Typisch sind die sog. Belastungsversuche: Mehrere Gruppen von Tieren werden mit verschiedenen Verdünnungen der Impfstoff-Charge sowie mit einem Referenzimpfstoff gespritzt. Einige Tiere dienen als „Kontrolle“ und werden nicht geimpft. Nach einer bestimmten Zeit wird den Tieren eine sehr hohe Dosis des Krankheitserregers verabreicht (Belastung), die bei den Kontrolltieren und bei den Tieren, die mit geringen Verdünnungen geimpft wurden, starke Krankheitssymptome wie Krämpfe, Lähmungen und Atemnot verursacht und zum qualvollen Tod der Tiere führt. Das Ziel dieser Versuche ist es, die LD50 (Letale Dosis 50 = die Impfstoffverdünnung, bei der 50% der Tiere sterben) zu ermitteln. Alternativ können die Tiere für manche Impfstoffe nicht mit dem Krankheitserreger belastet werden, sondern es wird die Antikörpermenge in Blutproben der geimpften Tiere bestimmt. Diese Methode ist nicht ganz so leidvoll wie die klassische LD50-Bestimmung und wird für die Impfstoffe, für die sie zugelassen ist, bevorzugt. Allerdings werden die Tiere am Ende der Versuche auch hier getötet. Bei der Wirksamkeitstestung mancher Impfstoffe erlaubt das Europäische Arzneibuch gänzlich oder teilweise den Ersatz der beschriebenen Tierversuche durch „eine validierte In-vitro-Methode“. Ob und wie häufig solche Methoden tatsächlich von den Impfstoff-Herstellern verwendet werden, ist leider unklar. 2019 wurden fast 140.000 Tiere für die Chargenprüfung der Wirksamkeit von Impfstoffen und anderen immunologischen Arzneimitteln in Deutschland verwendet, darunter Mäuse, Ratten, Meerschweinchen, Hamster, Kaninchen und andere (17).
Die Sicherheits-Chargenprüfung ist ebenfalls gesetzlich vorgeschrieben und soll die Unbedenklichkeit jeder Impfstoffproduktionseinheit gewährleisten. Hier sind auch sehr häufig verschiedene und zahlreiche Tierversuche vom Europäischen Arzneibuch vorgesehen (Tabelle 1). Ähnlich wie bei den Wirksamkeitsprüfungen werden Tierversuche in mehreren Stadien der Impfstoffproduktion durchgeführt, z.B. um die Unbedenklichkeit der aktiven Substanz und des fertigen Impfstoffs zu testen.
Je nach Impfstoffart und –technologie werden verschiedene Sicherheitsparameter in bestimmten Tierversuchen geprüft. Für Toxoid-Impfstoffe, wie die für Diphtherie und Tetanus, deren aktiven Substanz aus einem inaktivierten Bakterientoxin („Toxoid“) besteht, wird die Abwesenheit vom aktiven, giftigen Toxin bestimmt, indem das Toxoid Tieren (z.B. Meerschweinchen) in einer höheren Dosis als im fertigen Impfstoff für Menschen injiziert wird. Einige Wochen lang wird beobachtet, ob die Tiere Vergiftungssymptome entwickeln oder sterben.

Beim Pyrogentest werden Kaninchen in enge Kästen gezwängt.
Fast alle Impfstoffe müssen zudem auf die Abwesenheit von Pyrogenen oder Endotoxinen geprüft werden. Pyrogene sind fieberauslösende Substanzen, die durch Verunreinigungen mit Bakterien, Viren, Pilzen oder künstlichen Materialien wie Kunststoff- oder Metallabrieb bei der Impfstoffherstellung auftreten können. Endotoxine sind Bakterienbestandteile. Beim „klassischen“ Pyrogentest am Kaninchen werden die Tiere in enge Kästen gesteckt, sodass sie sich nicht bewegen können, die Testsubstanz (Impfstoff oder Impfstoffbestandteil) wird ihnen in eine Ohrvene injiziert und ihre Körpertemperatur wird durch ein Thermometer im Anus erfasst. Dieser Test ist mit enormem Stress für die Kaninchen verbunden, es kommt manchmal auch zu Fieber, Atembeschwerden und Schock. Allein in Deutschland wurden 6.457 Kaninchen 2019 für den Pyrogentest von Impfstoffen und anderen Medikamenten verwendet (17).
Eine behördlich zugelassene „Alternative“ für den Pyrogentest am Kaninchen ist der Limulus-Amöbozyten-Test (LAL-Test), der die An- oder Abwesenheit von Endotoxinen überprüft. Für diesen Test wird Blut von wild gefangenen Pfeilschwanzkrebsen verwendet: Die Tiere werden im großen Maßstab gefangen und in spezialisierte Labore geschafft, wo ihnen ein Drittel ihres blauen Blutes ohne Betäubung abgezapft wird. Viele Tiere überleben die Prozedur nicht. Da dieser Test mit großem Tierleid verbunden ist, stellt er keine ethisch vertretbare „Alternative“ für den Pyrogentest am Kaninchen dar. Beim rFC-Test (rekombinanter Faktor C) wird das Molekül, auf dem der LAL-Test basiert, synthetisch statt aus Pfeilschwanzkrebsen gewonnen. Seit Januar 2021 ist der rFC-Test als LAL-Test-Alternative im Europäischen Arzneibuch zugelassen (18).
Der Monozyten-Aktivierungs-Test (MAT-Test) ist eine tierversuchsfreie Testmethode für die Prüfung auf Pyrogene, die auf menschlichen Blutzellen (Monozyten) basiert und seit 2010 im Europäischen Arzneibuch zugelassen ist. Der MAT hat nicht nur ethische Vorteile, sondern man kann damit eine weitaus größere Bandbreite an fieberauslösenden Verunreinigungen aufspüren als mit dem Kaninchen oder dem LAL-Test. ÄgT fordert die Anwendung der tierversuchsfreien rFC- und MAT-Tests anstatt des Pyrogentests am Kaninchen und des LAL-Tests.
Andere Sicherheits-Chargenprüfungen werden durchgeführt, um die Keimfreiheit der biologischen Komponente des Herstellungssystems, z.B. tierischer Zellen oder Bruteier, zu testen. 2019 wurden 25.013 Tiere zusätzlich zu den 6.457 Kaninchen für den Pyrogentest in Deutschland für Sicherheits-Chargenprüfungen von Impfstoffen und anderen immunologischen Arzneimitteln verwendet (17).
Erfolge bei der Abschaffung von Tierversuchen in den Impfstoff-Chargenprüfungen
Viele Organisationen und Programme in Europa und weltweit arbeiten seit Jahrzehnten daran, den Einsatz von Tieren bei Impfstoff-Chargenprüfungen zu reduzieren. Es gibt vier Haupttreiber für diese Bemühungen: 1. Tierschutz, weil sehr viele Tiere in den qualvollen Tierversuchen verwendet werden; 2. wissenschaftliche Gründe, da viele der üblichen Tierversuche sehr variable, unzuverlässige und nicht übertragbare Ergebnisse liefern; 3. wirtschaftliche Gründe, da Tierversuche i.d.R. teurer, aufwendiger und langwieriger als In-vitro-Methoden sind; und 4. regulatorische Gründe, weil das EU-Recht vorsieht, Tierversuche wenn möglich zu reduzieren und zu ersetzen (19). Infolgedessen wurden einige Tierversuche gestrichen, durch In-vitro-Methoden ersetzt oder einige tierversuchsfreie Methoden wurden zusätzlich zu den üblichen Tierversuchen im Europäischen Arzneibuch aufgelistet (20). Einige positive Beispiele der letzten Jahre:
- 2014 wurde z.B. eine immunologische In-vitro-Methode (ELISA) offiziell anerkannt, um die Antigenkonzentration des Hepatitis-A-Impfstoffs zu bestimmen, was bisher an Mäusen getestet wurde. Der Mausversuch wurde leider nicht aus dem Europäischen Arzneibuch gestrichen, d.h. jeder Hersteller darf sich immer noch frei entscheiden, ob er den Tierversuch oder die tierversuchsfreie Methode verwenden will.
- 2015 wurden einige Tierversuche an Meerschweinchen und adulten Mäusen für die Testung für bestimmte Impfstoffverunreinigungen aus dem Europäischen Arzneibuch gestrichen und die bis dahin übliche Verwendung von Baby-Mäusen und Bruteiern für diese Zwecke wurde eingeschränkt (20).
- 2016 wurde das Kapitel im Europäischen Arzneibuch über den MAT-Test überarbeitet, um die Verwendung dieser tierversuchsfreien Methode statt des Pyrogentests am Kaninchen zu fördern (20).
- 2017 wurde die Prüfung auf anomale Toxizität an Mäusen und Meerschweinchen für alle neuen Impfstoffe aus dem Europäischen Arzneibuch gestrichen, nachdem seine Aussagekraft für mehr als zwei Jahrzehnte in Frage gestellt wurde (13,19,20). Diesen Test gibt es bereits seit über 100 Jahren und er wurde früher als Routinetest bei allen Impfstoffen durchgeführt.
- 2018 wurde eine auf Zellkulturen basierende In-vitro-Methode vom Europäischen Arzneibuch anerkannt, um einige Mausversuche für die Sicherheitsprüfungen der aktiven Substanz und teilweise des fertigen Keuchhusten-Impfstoffs zu ersetzen (19,20).
- 2019 wurden drei Sicherheitsprüfungen an Meerschweinchen für den Tetanus-Impfstoff aus dem Europäischen Arzneibuch gestrichen (20). Weitere ähnliche Versuche an Meerschweinchen sind aber leider immer noch während des Herstellungsprozesses dieses Impfstoffs vorgeschrieben und werden nach wie vor durchgeführt.
- Seit 2021 ist der rFC-Test als Alternative zum LAL-Test im Europäischen Arzneibuch anerkannt (18).
- Weiterhin erlaubt das Europäische Arzneibuch die Verwendung von In-vitro-Methoden an Stelle der üblichen Tierversuche für die Wirksamkeitsprüfung der inaktivierten Poliomyelitis-, Tollwut-, Hepatitis-A-, Hepatitis-B-, Haemophilus influenza- und Papillomaviren-Impfstoffe (19).
- Im Laufe der letzten vier Jahrzehnte wurden weitere Verbesserungen in den Regularien vorgenommen, wie der Ersatz des Neurovirulenztests an Affen für Poliomyelitis-Lebendimpfstoffe durch eine In-vitro-Methode (13).
Innovative Impfstoff-Prüfung ohne Tiere

Mit der Organ-on-a-chip-Technologie können menschliche Mini-Lymphknoten für die Impfstoffforschung gezüchtet werden. Bildquelle: LuchscherF/stock.adobe.com
Während die rechtliche Einführung tierversuchsfreier Methoden anstelle der üblichen Tierversuche für die Impfstoff-Chargenprüfungen ein langwieriger Prozess ist, wächst das wissenschaftliche Feld dieser innovativen, menschenrelevanten Technologien rasant.
- Menschliche Mini-Lymphknoten, aus menschlichen Zellen gezüchtete sogenannte Lymphknoten-Organoide, wie die des amerikanischen Unternehmens Prellis Biologics oder der deutschen Firma ProBioGen AG, werden verwendet, um die menschliche Immunantwort und Antikörperproduktion auf verschiedene Substanzen und Impfstoffe zu analysieren (21,22).
- Mittels Lymphknoten-auf-dem-Chip-Systeme, die man z.B. mit einem Influenza-Impfstoff behandelt, können personenspezifische Immunreaktionen untersucht und Wirksamkeit und Sicherheit von Impfstoffen analysiert werden (23).
- Das auf menschlichen Blut- und Immunzellen basierende, modulare MIMIC-System kann als vorläufiges Screening für Wirksamkeitstests potenzieller Impfstoffformulierungen dienen und zur Messung der Immunsystem-Stimulation von Impfstoffen verwendet werden (24).
- Eine Kombination aus geeigneten Zelltypen und bestimmten biochemischen Methoden ist in der Lage, die Wirksamkeit des FSME-Impfstoffs zu bestimmen und könnte somit die entsprechenden Tierversuche für die Chargenprüfungen dieses Impfstoffs ersetzen (25).
- Moderne, leistungsstarke Computerprograme werden auch für die Analyse von Impfstoffen eingesetzt. So wurde kürzlich ein Computeralgorithmus entwickelt, um die Wirksamkeit von Corona-Impfstoffen vorherzusagen (26).
Diese und weitere Beispiele zeigen deutlich, dass es nicht an modernen, menschenrelevanten, tierversuchsfreien Methoden mangelt, die für die Entwicklung und Testung von Impfstoffen eingesetzt werden können und die Wirksamkeit und Sicherheit dieser Impfstoffe gewährleisten können.
Warum werden Tierversuche für die Impfstoff-Chargenprüfungen immer noch gemacht?
Die gesetzlich vorgeschriebene Validierung und Anerkennung tierversuchsfreier Testmethoden und der Ersatz von „klassischen“ Tierversuchen, die seit Jahrzehnten durchgeführt werden, ist ein komplexer, langwieriger Prozess. Viele Standard-Tierversuche in den Chargenprüfungen von Impfstoffen sind vor mehreren Jahrzehnten oder sogar vor einem Jahrhundert eingeführt worden. Obwohl diese veralteten Tierversuche nie validiert wurden und viel unzuverlässiger als die modernen, heutigen tierversuchsfreien Testmethoden sind, gelten sie seit Jahrzehnten als „Goldstandard“ und werden durchgeführt, ohne hinterfragt zu werden. Bei den hohen Qualitätsstandards und der guten Herstellungspraxis (GMP), die heutzutage die Einheitlichkeit der Impfstoffherstellung gewährleisten, erscheinen Tierversuche wie aus einer anderen Zeit. Häufig werden Tierversuche durchgeführt, auch wenn tierversuchsfreie Methoden für denselben Zweck schon längst vorhanden und regulatorisch akzeptiert sind. Ein tragisches Beispiel ist der MAT-Test, der seit 2010 vom Europäischen Arzneibuch als Alternative für den Pyrogentest am Kaninchen anerkannt ist. Trotzdem werden jährlich mehr als 6000 Kaninchen in Deutschland für die Prüfung auf Pyrogene verwendet (17). Die praktische Umsetzung der verbesserten regulatorischen Richtlinien wird mit zahlreichen Hürden konfrontiert.
Ein großes Problem ist die Abwesenheit einer weltweiten Harmonisierung der Anforderungen für die Impfstoff-Prüfungen. Das bedeutet, dass einige Tierversuche in manchen Ländern verlangt werden und in anderen nicht, oder dass (manchmal minimal) unterschiedliche Tierversuche in den verschiedenen Ländern vorgeschrieben sind. Impfstoffhersteller, die ihre Produkte weltweit verkaufen möchten, sind dadurch gezwungen, diese Tierversuche durchzuführen. So ist etwa die Prüfung auf anomale Toxizität an Mäusen und Meerschweinchen, die seit 2015 und 2017 in den USA bzw. in der EU nicht mehr verlangt wird, immer noch in vielen anderen Ländern mit großen, lukrativen Märkten wie China, Japan, Mexiko und Russland gesetzlich vorgeschrieben (27). Internationale Programme wie Animal-Free Safety Assessment (AFSA), eine Zusammenarbeit zwischen Humane Society International (HSI) und mehreren Unternehmen, zielen auf die globale Angleichung (Harmonisierung) der regulatorischen Prüfrichtlinien für die Impfstoff-Chargenprüfungen (28).
Ein weiteres Problem ist die Komplexität des regulatorischen Validierung- und Anerkennungsprozess. Die Validierung umfasst drei Phasen, die 10-15 Jahre oder noch länger dauern können und die mit einem großen Aufwand wie die mehrfache Überprüfung der Methode sowohl intern als auch an 10-20 internationalen Laboren, die Einreichung umfangreicher Unterlagen und die Beschaffung von Lizenzen verbunden sind (29). Dieses aufwendige Procedere verlangsamt die Entwicklung von tierversuchsfreien Testmethoden und entmutigt die Impfstoffhersteller, diese anzuwenden. Das ist einer der Hauptgründe, warum die Pharmaunternehmen die im Europäischen Arzneibuch anerkannten tierversuchsfreien Methoden nicht vollständig implementieren (19). Für den Diphtherie-Impfstoff wird z.B. eine tierversuchsfreie Methode statt eines Tierversuchs an Meerschweinchen für die Testung der Toxizität im Europäischen Arzneibuch anerkannt. Wegen länderspezifischer Anforderungen wird der Ersatz dieses Tierversuchs aber nur teilweise implementiert (19).
Weiterhin ist es problematisch, dass viele Tierversuche nicht eins-zu-eins durch eine tierversuchsfreie Methode ersetzt werden können, was häufig von den entsprechenden Behörden verlangt wird. Stattdessen wäre es sinnvoll, passende Messparameter für die tierversuchsfreie Methode zu bestimmen. Für manche Zwecke kann auch eine Kombination mehrerer Methoden sinnvoll sein. Dies wird aber von den meisten Behörden (noch) nicht akzeptiert.
Für die älteren Impfstoffe führen manche Hersteller die vorgeschriebenen Chargenprüfungen seit Jahren mithilfe bestimmter Tierversuche durch und haben etablierte Produktionsketten und Prüfprozesse. In diesen Fällen kann es zumindest am Anfang wirtschaftlich ungünstig sein, die bestehenden Test-Systeme zu verändern, um einige Tierversuche zu ersetzen. Dasselbe gilt auch für den Umstieg von einem Produktionssystem, das auf tierischen Materialien wie Bruteiern basiert, auf einen tierfreien Herstellungsprozess.
Ein weiterer Grund für nur schleppenden Fortschritte ist, dass die tierversuchsfreien Methoden häufig produktspezifisch, d.h. für jeden einzelnen Impfstoff oder jede einzelne Testsubstanz, validiert werden müssen. Das ist auch beim MAT-Test der Fall, der jedes Mal einen Validierungsprozess durchlaufen muss, wenn ein Impfstoffhersteller ihn für ein neues Produkt verwenden möchte (30). Im Gegensatz dazu darf der Pyrogentest am Kaninchen ohne eine solche Validierung für alle Substanzen verwendet werden. Dieser Doppelstandard führt dazu, dass es für die Hersteller einfacher ist, die üblichen Tierversuche weiter durchzuführen statt für jedes Produkt den langwierigen Validierungsprozess anzugehen.
Fazit / Unsere Forderungen
Die Impfstoffforschung ist ein Bereich, der sich seit Jahrhunderten entwickelt und deren Anfang auf Beobachtungen und Experimenten mit Menschen beruht. Die Impfstoffentwicklung und -herstellung unterliegen strengen internationalen und staatlichen Richtlinien, die häufig mit einem enormen Tierverbrauch und vielen Tierversuchen verbunden sind. Jährlich werden Millionen von Tieren qualvollen Tierversuchen im Rahmen der regulatorischen Chargenprüfungen auf Sicherheit und Wirksamkeit jeder einzelnen Impfstoff-Produktionseinheit ausgesetzt. Dabei handelt es sich meistens um veraltete Tierversuche, die seit Jahrzehnten als „Goldstandard“ gelten, obwohl es heutzutage viele effektivere, tierversuchsfreie Testmethoden gibt. In den letzten Jahrzehnten wurden einige Erfolge erzielt, indem bestimmte Tierversuche für die Impfstoff-Chargenprüfungen mit tierversuchsfreien Methoden ersetzt oder ersatzlos gestrichen wurden. Dennoch ist die regulatorische Akzeptanz von tierversuchsfreien Testmethoden ein unglaublich langwieriger Prozess, bei dem es viele Hindernisse gibt. Ein großes Problem sind die unterschiedlichen Richtlinien für die Chargenprüfungen in verschiedenen Ländern, die dazu führen, dass sehr viele Tierversuche doppelt oder mehrfach gemacht werden.
Ärzte gegen Tierversuche setzt sich für eine tierfreie Impfstoffherstellung, für die Abschaffung der Tierversuche und die konsequente Umsetzung der regulatorisch anerkannten tierversuchsfreien Testmethoden für die Impfstoff-Chargenprüfungen ein. Tierversuche für Prüfungen, bei denen tierversuchsfreie Testmethoden bereits gesetzlich anerkannt sind, müssen umgehend aus dem Europäischen Arzneibuch gestrichen werden. Wir fordern von den deutschen und europäischen Behörden, anstelle von überholten Tierversuchen die Anwendung von menschenrelevanten, tierversuchsfreien Testmethoden zu ermöglichen und erleichtern. Weiterhin müssen Entwicklung und Validierung dieser Methoden viel besser finanziert und die entsprechenden Validierungsprozesse beschleunigt werden.
1. Juni 2021
Dr. rer. nat. Dilyana Filipova
Quellen
- WHO: Immunization coverage, 15.7.2020
- Deutsches Grünes Kreuz für Gesundheit e.V.: Hintergrundwissen: Die verschiedenen Impfstoff-Typen, 13.10.2020
- WHO: Vaccine regulation
- Paul-Ehrlich-Institut: Impfstoffe, 21.11.2019
- European Medicines Agency: Comirnaty, 21.12.2020
- European Medicines Agency: COVID-19 Vaccine Moderna, 4.1.2021
- European Medicines Agency: COVID-19 Vaccine AstraZeneca, 25.1.2021
- European Medicines Agency: COVID-19 Vaccine Janssen, 5.3.2021
- Precision Vaccinations: 500 million easter eggs could be saved by the FDA, 29.3.2018
- Zost SJ et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. PNAS 2017; 114(47):12578–12583
- British American Tobacco: BAT progresses COVID-19 candidate vaccine into Phase I human clinical trials, 16.12.2020
- Papathanasiou P et al. Transparency in drug regulation: public assessment reports in Europe and Australia. Drug Discov Today 2016; 21(11):1806–1813
- Cußler K et al. Alternativen zu Tierexperimenten: wissenschaftliche Herausforderungen und Perspektiven, Spektrum Akademischer Verlag, 1996, S. 163–188
- Halder M Three Rs potential in the development and quality control of immunobiologicals. ALTEX 2001; 18 Suppl 1:13–47
- EDQM: Batch release for human biologicals: vaccines, blood and plasma derivatives
- Europäisches Arzneibuch 9.8, Deutscher Apotheker Verlag, 2019
- BMEL: Verwendung von Versuchstieren im Jahr 2019, 12.8.2020
- Deutschmann S et al. General chapter on the rFC test adopted by the European Pharmacopoeia Commission. Eur Pharm Rev 2020; 25(1):23–25
- Uhlrich S et al. Alternatives to Animal Testing, Springer, 2019, S. 76–82
- EDQM: Replacement, reduction and refinement of animal testing (3Rs): latest achievements
- Business wire: Prellis Biologics, Inc. generates 300 human antibodies that bind the SARS-CoV2 virus; pursues development of a treatment and preventative therapy for COVID-19 infection
- Giese C et al. Immunological substance testing on human lymphatic micro-organoids in vitro. J Biotechnol 2010; 148(1):38–45
- Goyal G et al. Lymph node follicle formation and vaccination responses reconstituted in vitro in a human Organ Chip. bioRxiv 2019; doi: 10.1101/806505:806505
- Byers AM et al. In vitro antibody response to tetanus in the MIMICTM system is a representative measure of vaccine immunogenicity. Biologicals 2009; 37(3):148–151
- Signorazzi A et al. In vitro assessment of tick-borne encephalitis vaccine: Suitable human cell platforms and potential biomarkers. ALTEX 2021; doi: 10.14573/altex.2010081
- Russo G et al. In Silico Trial to test COVID-19 candidate vaccines: a case study with UISS platform. bioRxiv 2020; doi: 10.1101/2020.05.06.080630:2020.05.06.080630
- Viviani L et al. Global harmonization of vaccine testing requirements: Making elimination of the ATT and TABST a concrete global achievement. Biologicals 2020; 63:101–105
- AFSA: Vaccines regulatory alignment
- Halder M et al. Recommendations of the VAC2VAC workshop on the design of multi-centre validation studies. Biologicals 2018; 52:78–82
- Norwig J. Mikrobiologische und biologische Methoden des Europäischen Arzneibuchs. Bundesgesundheitsbl 2014; 57(10):1158–1168
